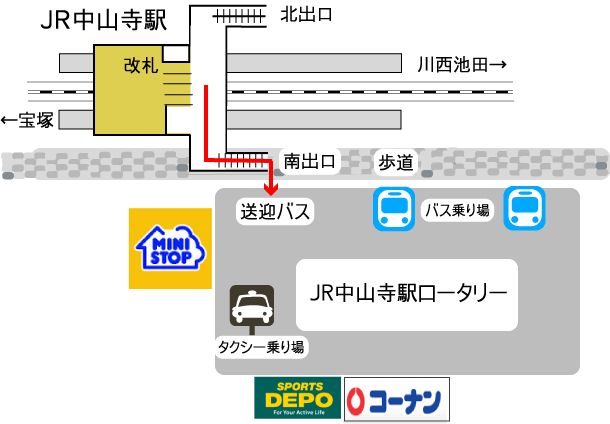
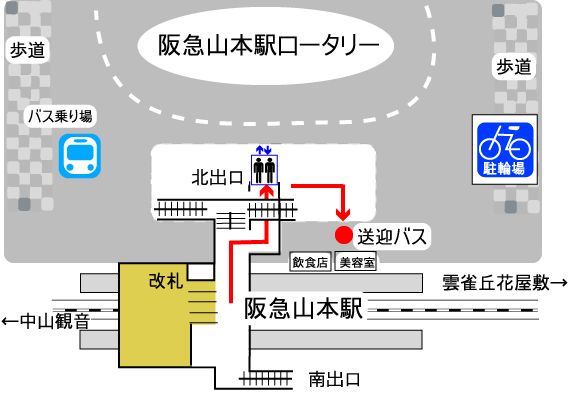
治験管理室
当院では、質の高い治験を倫理的な配慮の下に、科学的に、適正かつ効率的に進めるため、平成26年4月に治験管理室を開設しました。
当治験管理室では各種臨床試験と臨床研究の管理および実施の支援を行います。
治験とは?
新しい薬や医療機器等が厚生労働省で承認されるために必要な試験です。新しい薬や医療機器等が世の中で使われるようになるまでには、その「有効性(効果)」と「安全性(副作用)」の評価を行う必要があります。その最後の段階で人での効果と安全性を調べる段階を治験といいます。
新薬ができるまで
基礎研究非臨床試験
薬になる可能性のある物質を選び、動物を用いて、物質の有効性や安全性などを研究します。臨床試験(治験)
人での有効性や安全性などを3段階に分けて調べます。第Ⅰ相試験
少数の健康な人を対象に、薬の安全性や薬が体の中でどのように行き渡るのかを調べます。第Ⅱ相試験
少数の患者さんを対象に、有効で安全な薬の量や使い方を調べます。第Ⅲ相試験
多くの患者さんを対象に、有効性と安全性を、すでに発売されている薬などと比較します。承認審査
治験のデータを基に、厚生労働省が薬としてふさわしいかどうか、治験が倫理的・科学的に行われたかなどを厳しく審査します。ここで認められると、初めて薬として販売することができます。
製造販売後臨床試験
第Ⅳ相試験
厚生労働省の認可を受け薬が市販されると、治験を行った時よりも薬を使用する方が急激に増え、その方々の性別、年齢、また、他の薬との併用の有無など様々な条件が加わり、治験では分からなかったその薬の効果や副作用が発生する場合があります。その為、市販された後も、継続的に有効性と安全性をさらに評価・分析する必要があります。この評価・分析する試験を製造販売後臨床試験と言います。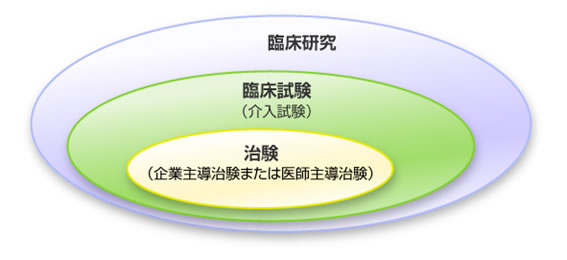
治験審査委員会(Institutional Review Board(以下、IRB))について
当院ではIRBを外部(セントラルIRB)に委託しています。このセントラルIRBは薬事法第80条の2(治験の取扱い)に規定されているものであり、院内にIRBを持たない複数の医療機関から委託をされて治験の審査を一括して行う特定の医療機関のIRBです。
セントラルIRBの利用により、各実施医療機関での重複審議を避け、スピード化による試験進捗への貢献、広範囲な専門性をもつ委員の確保、委員会の安定した運営と開催、調査機能の充実、資料の一元保管といった効果が得られています。また、セントラルIRBは、治験の効率化のみならず審査の機能向上の観点から国から活用が奨励されています。